
Ejemplos especiales del control «metabólico»
a corto plazo del flujo sanguíneo local
Los mecanismos para controlar
el flujo sanguíneo local se denominan «mecanismos
metabólicos» porque todos ellos funcionan en respuesta a las
necesidades metabólicas de los tejidos.
Hay otros dos ejemplos
especiales de control metabólico del flujo sanguíneo
local, la hiperemia reactiva y la hiperemia activa.
Hiperemia reactiva. Cuando la sangre que irriga un tejido se bloquea durante unos segundos durante 1 h o más, y después se desbloquea, el flujo sanguíneo que atraviesa el
tejido aumenta inmediatamente hasta 4-7 veces con respecto a lo normal; este aumento del flujo continuará durante varios segundos, si el bloqueo ha durado sólo unos segundos, pero a veces continuará muchas horas, si el flujo sanguíneo ha estado
interrumpido durante 1 h o más. Este fenómeno se conoce como hiperemia reactiva.

La hiperemia reactiva es otra manifestación del mecanismo de regulación «metabólico» del flujo sanguíneo, es decir, la falta de flujo pone en marcha todos estos factores
que provocan la vasodilatación. Después de períodos cortos de oclusión vascular la cantidad extra de flujo sanguíneo que aparece durante la fase de hiperemia reactiva dura lo suficiente como para reponer casi exactamente el déficit de oxígeno tisular que se ha acumulado durante el período de oclusión. Este mecanismo resalta la estrecha conexión existente entre la regulación del flujo sanguíneo local y el aporte de oxígeno y de otros nutrientes a los tejidos.
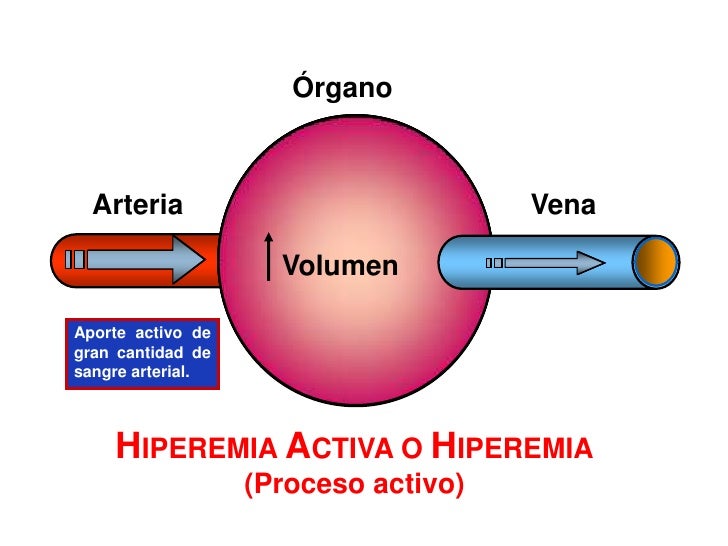
Hiperemia activa. Cuando cualquier tejido se vuelve muy
activo, como un músculo que hace ejercicio, una glándula gastrointestinal durante el período hipersecretor o incluso en el cerebro durante la actividad mental rápida, la velocidad del flujo sanguíneo aumenta a través del tejido. En este caso, de
nuevo, se puede entender fácilmente esta hiperemia activa si se aplican los principios básicos de control del flujo sanguíne local. El incremento del metabolismo local hace que las células devoren rápidamente los nutrientes del líquido tisular y
también que liberen grandes cantidades de sustancias vasodilatadoras.
El resultado es que se dilatan los vasos sanguíneos locales y, por tanto, aumenta el flujo sanguíneo local. De esta forma, el tejido activo recibe los nutrientes adicionales necesarios para mantener este nuevo nivel de funcionamiento.
Como ya hemos mencionado, la hiperemia activa del músculo esquelético aumenta el flujo sanguíneo muscular local hasta en 20 veces durante el ejercicio intenso.
«Autorregulación» del flujo sanguíneo cuando
la presión arterial cambia de la normalidad:
mecanismos «metabólicos» y «miógenos»
En cualquier tejido del organismo el rápido incremento de la presión arterial provoca un aumento inmediato del flujo sanguíneo, pero en menos de 1 min ese flujo volverá a la
normalidad en la mayoría de los tejidos, incluso aunque la presión arterial se mantenga elevada. Esta normalización del flujo se denomina «autorregulación del flujo sanguíneo».
Una vez se haya producido esta autorregulación, el flujo sanguíneo local de la mayoría de los tejidos del organismo estará relacionado con la presión arterial, aproximadamente según la curva «aguda» de trazo continuo
Obsérvese que entre una presión arterial de 70 mmHg y otra de 175 mmHg se produce un aumento del flujo sanguíneo sólo del 20 al 30%, incluso cuando la presión arterial aumente en un 150%.
Durante casi un siglo se han mantenido dos opiniones que explicarían el mecanismo de autorregulación a corto plazo, la teoría metabólica y la teoría miógena.

La teoría metabólica se puede entender fácilmente si se aplican los principios básicos de regulación del flujo sanguíneo local que hemos comentado en las secciones previas.
Es decir, cuando la presión arterial es demasiado elevada, el exceso de líquido proporciona demasiado oxígeno y demasiados nutrientes de otro tipo hacia los tejidos y «lava» los vasodilatadores liberados por los tejidos. Estos nutrientes
(en especial, el oxígeno), junto con el descenso en los niveles tisulares de vasodilatadores, provocan entonces la constricción de los vasos sanguíneos y el retorno del flujo casi a la normalidad, a pesar de que aumente la presión.
No obstante, según esta teoría miógena habría otro mecanismo no relacionado con el metabolismo tisular que explicaría el fenómeno de la autorregulación.
Esta teoría se basa en la observación de que el estiramiento brusco de los vasos sanguíneos pequeños provoca la contracción del músculo liso
Por tanto, se ha propuesto que cuando una presión arterial elevada estira el
vaso se provoca, a su vez, una constricción vascular reactiva que reduce el flujo sanguíneo casi a la normalidad. Por el contrario, con presiones bajas el grado de estiramiento del vaso es menor, por lo que el músculo liso se relaja, reduce la resistencia
vascular y ayuda a recuperar la normalidad del flujo.

La respuesta miógena es inherente al músculo liso vascular y puede producirse en ausencia de influencias nerviosas u hormonales. Es más pronunciada en las arteriolas, pero se puede ver también en arterias, vénulas, venas e incluso
en vasos linfáticos.
La contracción miógena se inicia por la despolarización vascular inducida por el estiramiento, que tiende a aumentar rápidamente la entrada de ion calcio desde
el líquido extracelular hacia las células, provocando su contracción. Los cambios de la presión vascular también pueden abrir o cerrar otros canales iónicos que influyen en la contracción vascular. Se desconocen los mecanismos por los cuales
los cambios de la presión provocan la apertura o el cierre de los canales iónicos vasculares, pero es probable que consistan en efectos mecánicos de la presión sobre las proteínas extracelulares que están ancladas en los elementos del citoesqueleto
de la pared vascular o en los propios canales iónicos. El mecanismo miógeno parece ser importante para prevenir el estiramiento excesivo del vaso sanguíneo cuando
aumenta la presión sanguínea. No obstante, también se desconoce la importancia de este mecanismo en la regulación del flujo sanguíneo porque este mecanismo de detección de la presión no puede detectar directamente los cambios
del flujo sanguíneo en el tejido. En realidad, los factores metabólicos anulan el mecanismo miógeno cuando las demandas metabólicas de los tejidos están significativamente aumentados, como durante el ejercicio muscular enérgico, lo que
provoca un incremento espectacular del flujo sanguíneo en el músculo esquelético.
Mecanismos especiales del control a corto plazo
del flujo sanguíneo en tejidos específicos
Aunque los mecanismos generales de control del flujo sanguíneo
local que hemos comentado hasta ahora actúan en la mayoría de los tejidos del organismo, en algunos territorios especiales actúan otros mecanismos totalmente diferentes. Todos los mecanismos se comentarán en este texto en relación
con cada órgano específico, pero hay dos que merecen una atención especial:

En los riñones, el control del flujo sanguíneo se basa en
gran medida en un mecanismo denominado retroalimentación tubuloglomerular, en el que una estructura epitelial
del túbulo distal, la mácula densa, detecta la composición
del líquido al inicio de dicho túbulo. La mácula se sitúa en la
zona en que el túbulo distal se encuentra cerca de las arteriolas
aferente y eferente del aparato yuxtaglomerular de la nefrona. Cuando se filtra demasiado líquido de la sangre a
través del glomérulo hacia el sistema tubular, las señales de retroalimentación de la mácula densa provocan constricción de las arteriolas aferentes, reduciendo de esta forma tanto el flujo sanguíneo renal como la tasa de filtración glomerular a valores normales o casi normales.
En el cerebro, además del control del flujo sanguíneo dependiente de la concentración de oxígeno tisular, las concentraciones de dióxido de carbono y de iones
hidrógeno tienen una gran importancia. El aumento de cualquiera de ellos dilata los vasos cerebrales y permite el lavado rápido del exceso de dióxido de carbono o de iones hidrógeno de los tejidos cerebrales, lo que es importante porque el nivel de excitabilidad del propio cerebro depende en gran medida del control exacto de las concentraciones de dióxido de carbono y del ion hidrógeno.
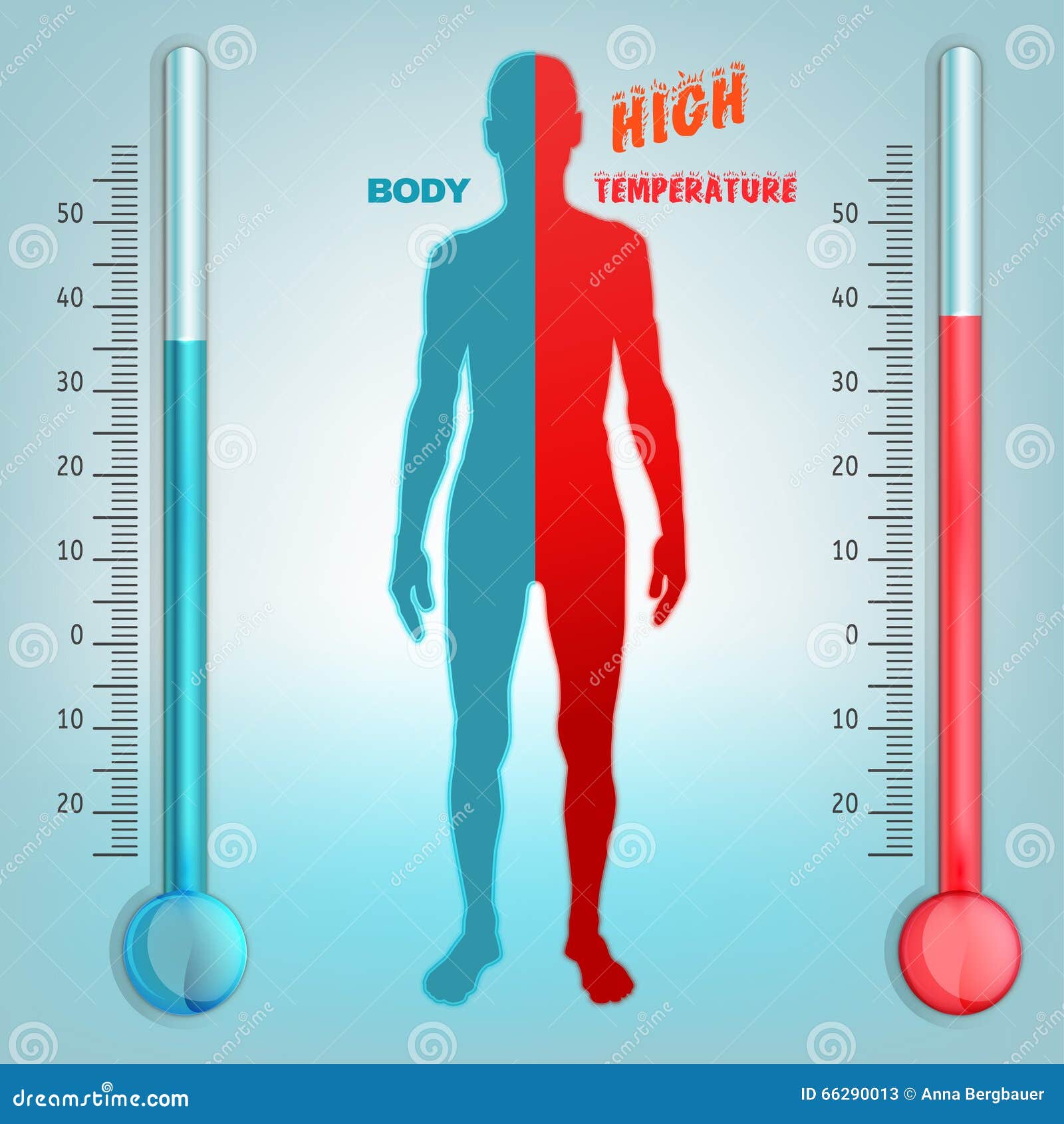
En la piel, el control del flujo sanguíneo está relacionado estrechamente con la regulación de la temperatura corporal. El flujo cutáneo y subcutáneo regula la pérdida de calor del cuerpo mediante la determinación del flujo de calor desde el centro a la superficie del organismo, donde se pierde calor hacia el medio exterior. El flujo sanguíneo en la piel está controlado en gran medida por el sistema
nervioso central a través de los nervios simpáticos
Aunque el flujo sanguíneo en la piel supone sólo en torno a 3 ml/min/100 g de tejido en
tiempo frío, cuando se necesita pueden producirse cambios importantes con respecto a estos valores. Cuando los seres humanos se exponen a un calentamiento, el flujo sanguíneo cutáneo puede incrementarse muchas veces, hasta 7 u 8 l/min para todo el organismo. Si se reduce la temperatura corporal, el flujo sanguíneo en la piel disminuye, para descender a poco más de cero a temperaturas muy bajas. Incluso con una vasoconstricción acusada, el flujo sanguíneo cutáneo suele ser suficientemente elevado para satisfacer las demandas metabólicas básicas de la piel.
Control del flujo sanguíneo tisular por medio
de factores de relajación y contracción
de origen endotelial
Las células endoteliales que recubren los vasos sanguíneos sintetizan varias sustancias que, cuando se liberan, afectan al grado de relajación o contracción de la pared arterial. Para muchos de estos factores de relajación o contracción de
origen endotelial, las funciones fisiológicas apenas se están empezando a comprender y, en la mayoría de los casos, todavía no se han desarrollado aplicaciones clínicas.
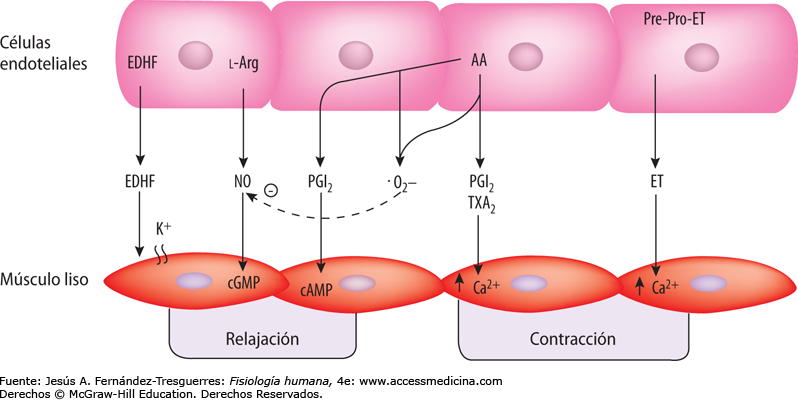
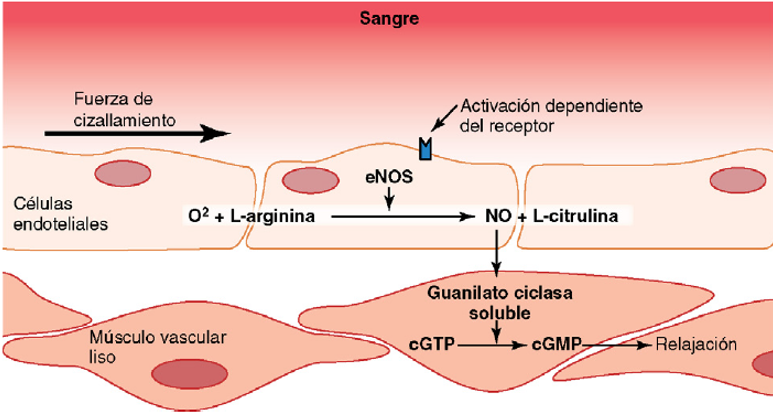
Óxido nítrico: un vasodilatador liberado por células endoteliales sanas. El más importante de los factores de relajación de origen endotelial es el óxido nítrico (NO), un
gas lipófilo que es liberado por las células endoteliales como respuesta a diversos estímulos químicos y físicos. La enzima óxido nítrico sintasa (NOS) de las células endoteliales sintetiza el NO a partir de arginina y oxígeno y por reducción
de nitrato inorgánico. Después de la difusión fuera de la célula endotelial, el NO tiene una semivida en sangre de sólo 6 s, aproximadamente, y actúa principalmente en los
tejidos locales en los que es liberado. El NO activa las guanilato
ciclasas solubles en las células de músculos lisos vascular lo que produce la conversión de trifosfato de guanosina cíclico (cGTP) a monofosfato de guanosina
cíclico (cGMP) y la activación de proteína cinasa dependiente de cGMP (PKG), que tiene varias acciones que provoca la relajación de los vasos sanguíneos. Cuando la sangre circula a través de las arterias y arteriolas provoca fuerzas de cizallamiento sobre las células endoteliales por el arrastre viscoso de la sangre contra las paredes vasculares. Esta tensión contorsiona las células endoteliales en la dirección del flujo y provoca un incremento significativo de la liberación de NO. El NO relaja entonces los vasos sanguíneos, lo que es una ventaja porque los mecanismos metabólicos
locales para el control del flujo sanguíneo tisular dilatan principalmente las arterias y arteriolas muy pequeñas en cada tejido. Aun así, cuando aumenta el flujo sanguíneo a través de una porción microvascular de la circulación, estimula de forma
secundaria la liberación de NO de los grandes vasos debido al aumento del flujo y a la tensión de cizallamiento en estos vasos.
El NO liberado aumenta los diámetros de los grandes vasos sanguíneos proximales siempre que el flujo sanguíneo microvascular aumenta distalmente. Sin esta respuesta disminuiría significativamente la eficacia del control del flujo sanguíneo
local, porque una parte significativa de la resistencia al flujo sanguíneo se produce en las pequeñas arterias proximales.
La síntesis y la liberación de NO desde las células endoteliales están estimuladas asimismo por algunos vasoconstrictores, como la angiotensina II, que se unen a receptores específicos en las células endoteliales. El aumento en la liberación
de NO protege contra un exceso de vasoconstricción. Cuando las células endoteliales resultan dañadas por hipertensión crónica o ateroesclerosis, la degradación en la síntesis de NO puede contribuir a una vasoconstricción excesiva y un
empeoramiento de la hipertensión y a un daño endotelial, que, si no se trata, puede producir finalmente lesión vascular y daños en tejidos vulnerables como el corazón, los riñones y el encéfalo. Antes de que se descubriera el NO, los médicos utilizaban
nitroglicerina, nitratos de amilo y otros derivados de nitratos para tratar a pacientes que sufrían angina de pecho, un dolor torácico intenso causado por isquemia del músculo cardíaco. Al descomponerse químicamente, estos fármacos liberan
NO y provocan la dilatación de vasos sanguíneos de todo el organismo, incluidos los vasos sanguíneos coronarios. Otras aplicaciones importantes de la fisiología y la farmacología del NO son el desarrollo y el uso clínico de
fármacos (p. ej., sildenafilo) que inhiben la fosfodiesterasa-5 (PDE-5) específica de cGMP, una enzima que degrada cGMP. Al impedir la degradación de cGMP, los inhibidores de PDE-5 prolongan eficazmente las acciones de NO
para provocar vasodilatación. El uso clínico principal de los inhibidores de PDE-5 es el tratamiento de la disfunción eréctil.
La erección se produce por medio de impulsos de los nervios parasimpáticos a través de los nervios pélvicos en el pene, donde se liberan los neurotransmisores
acetilcolina y NO. Al impedir la degradación de NO, los inhibidores de PDE-5 potencian la dilatación de los vasos sanguíneos en el pene y ayudan a la erección
Endotelina: un potente vasoconstrictor liberado por
endotelio dañado.

Las células endoteliales también liberan sustancias vasoconstrictoras. La más importante de las mismas es la endotelina, un péptido de 21 aminoácidos que
necesita sólo cantidades del orden de nanogramos para provocar una poderosa vasoconstricción. Esta sustancia está presente en las células endoteliales de todos o la mayoría de los vasos sanguíneos, aunque se eleva enormemente cuando
los vasos resultan dañados. El estímulo habitual para la liberación
es una lesión en el endotelio, como la provocada cuando se golpean los tejidos o se inyecta un producto químico traumatizante en el vaso sanguíneo. Después de un
daño importante en los vasos sanguíneos, la liberación de endotelina local y la posterior vasoconstricción ayudan a evitar una hemorragia extensa de arterias de hasta 5 mm de
diámetro que podrían haberse desgarrado por la lesión por aplastamiento.
Se cree también que el aumento en la liberación de endotelina contribuye a la vasoconstricción cuando el endotelio sufre daños debidos a la hipertensión. Se han utilizado fármacos que bloquean los receptores de endotelina para tratar
la hipertensión pulmonar, aunque en general no se han usado para reducir la presión arterial en pacientes con hipertensión arterial sistémica.
Regulación a largo plazo del flujo sanguíneo

Hasta este momento, la mayoría de los mecanismos de regulación del flujo sanguíneo local que hemos comentado actúan en pocos segundos o minutos después del cambio de
la situación tisular local. A pesar de ello, el flujo sanguíneo se ajusta sólo en las tres cuartas partes de las necesidades adicionales de los tejidos, incluso después de la activación completa de estos mecanismos agudos. Por ejemplo, el
flujo sanguíneo aumenta casi instantáneamente en un 100% cuando la presión arterial aumenta bruscamente desde 100 a 150 mmHg. En los 30 s a 2 min siguientes el flujo vuelve a disminuir hasta un 15% por encima del valor de control original,
lo que demuestra la rapidez de los mecanismos agudos de regulación del flujo sanguíneo local pero, al mismo tiempo, se demuestra que la regulación aún es incompleta porque se mantiene un incremento del 15% del flujo sanguíneo.
No obstante, en un período de horas, días o semanas, se
desarrolla una regulación a largo plazo del flujo sanguíneo local que se suma al control agudo.
Esta regulación a largo plazo consigue
un control mucho más completo del flujo sanguíneo. Por ejemplo, si la presión arterial se mantiene indefinidamente en 150 mmHg en el ejemplo anterior, en pocas semanas el flujo sanguíneo que atraviesa los tejidos se va aproximando gradualmente
casi exactamente al nivel de flujo normal. . Obsérvese que una vez que la regulación a largo plazo ha tenido tiempo de desarrollarse, los cambios a largo plazo de la presión arterial entre 50 y 250 mmHg tienen poco efecto sobre la velocidad de flujo sanguíneo local.
La regulación a largo plazo del flujo sanguíneo es especialmente importante cuando cambian las demandas metabólicas
del tejido a largo plazo. Es decir, si un tejido está crónicamente hiperactivo y, por tanto, requiere un aumento crónico de las cantidades de oxígeno y otros nutrientes, por
lo que en algunas semanas aumentan tanto el número como el tamaño de las arteriolas y los vasos capilares para cubrir las necesidades del tejido, a menos que el aparato circulatorio se vuelva patológico o sea demasiado viejo para responder.
Mecanismo de regulación a largo plazo: cambio de la «vascularización tisular»
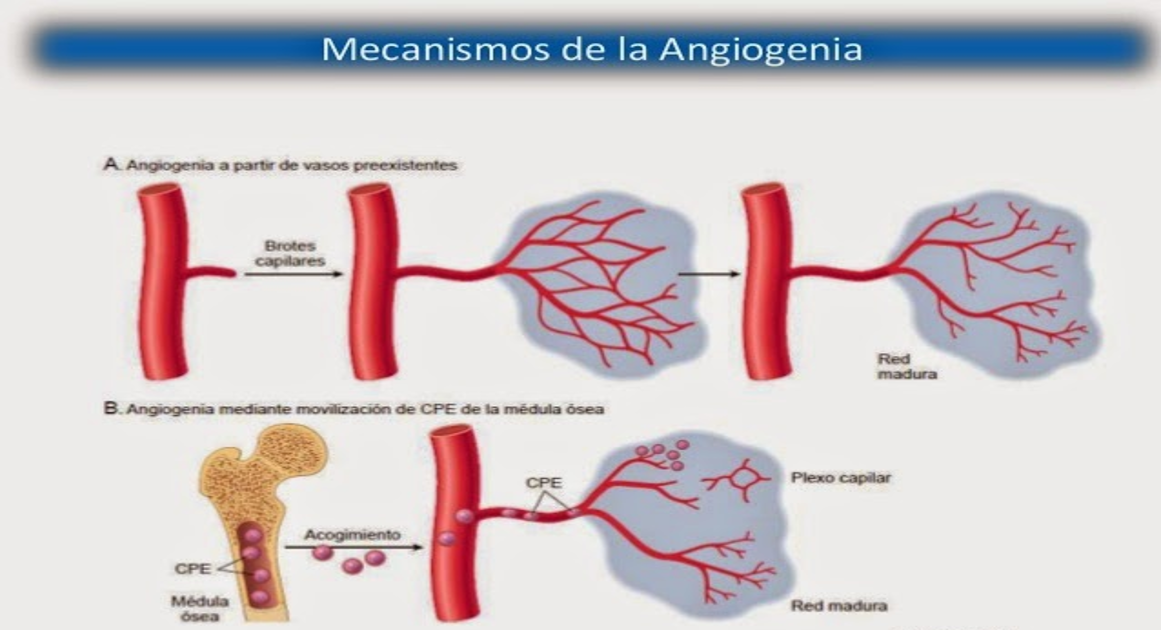
El mecanismo de regulación del flujo sanguíneo local a largo plazo consiste principalmente en cambiar la cantidad de vascularización de los tejidos. Por ejemplo, la vascularización aumenta si el metabolismo de un tejido dado aumenta durante un período prolongado, en un proceso denominado generalmente angiogenia; si el metabolismo disminuye, la vascularización también lo hace.
Es decir, se produce una reconstrucción física real de la vasculatura tisular para cubrirlas necesidades de los tejidos.
Esta reconstrucción es rápida (en días) en los animales muy jóvenes y también en un tejido de nuevo crecimiento, como en el tejido cicatricial o el tejido canceroso, pero es más lenta en los tejidos antiguos y bien establecidos. Por tanto, el tiempo necesario para que tenga lugar la regulación a largo plazo puede ser de sólo unos días en el recién nacido o hasta meses en la tercera edad. Además, el grado último de respuesta es mucho mejor en tejidos más jóvenes que en los más mayores, por lo que la vascularización se ajustará en el recién nacido, para cubrir casi exactamente las necesidades de flujo sanguíneo del tejido, mientras que en los más antiguos la vascularización va por detrás de las necesidades de los tejidos.

Función del oxígeno en la regulación a largo plazo.
El oxígeno es importante no sólo para el control a corto plazo del flujo sanguíneo local, sino también para el control a largo plazo. Un ejemplo es el aumento de la vascularización de los tejidos en los animales que viven en altitudes elevadas, donde el oxígeno atmosférico es bajo. Un segundo ejemplo es que los fetos de pollo incubados con oxígeno bajo tienen hasta el doble de conductividad en el tejido de los vasos sanguíneos de lo normal. Este mismo efecto también se demuestra espectacularmente en los niños recién nacidos prematuros que se introducen en tiendas de oxígeno con fines terapéuticos.
El exceso de oxígeno provoca la interrupción casi inmediata del crecimiento vascular nuevo en la retina de los ojos del niño prematuro e incluso provoca la degeneración de algunos de los vasos pequeños que ya se han formado. Después, cuando el niño es sacado de la tienda de oxígeno se produce un sobrecrecimiento explosivo de los vasos nuevos para compensar el descenso brusco del oxígeno disponible; en realidad, el sobrecrecimiento es tal que los vasos retinianos sobrepasan la retina hacia el humor vítreo del ojo, lo que terminará por provocar ceguera (afección que se conoce con el nombre de fibroplasia retrolental).

Importancia del factor de crecimiento endotelial vascular en la formación de vasos sanguíneos nuevos
Hay una docena o más de factores que aumentan el crecimiento de los vasos sanguíneos nuevos, siendo casi todos ellos péptidos pequeños. Tres de los mejor identificados son:
- El factor de crecimiento de los fibroblastos
- El factor de crecimiento del endotelio vascular (VEGF)
- La angiogenina
Aislados cada uno de ellos en tejidos que tienen un aporte sanguíneo inadecuado. Presumiblemente, es la deficiencia de oxígeno tisular o de otros nutrientes la que provoca la formación de los factores de crecimiento vascular (también denominados «factores angiogénicos»).
Prácticamente todos los factores angiogénicos favorecen el crecimiento de vasos nuevos del mismo modo, provocando la gemación desde otros vasos. El primer paso es la disolución de la membrana basal de las células endoteliales en el punto de gemación, seguida por la reproducción rápida de las células endoteliales nuevas que buscan la salida a través de la pared del vaso en cordones que se van extendiendo directamente hacia la fuente del factor angiogénico.
Las células de cada cordón continúan dividiéndose y se pliegan rápidamente formando
un tubo. A continuación, este tubo se conecta con otro tubo que ha nacido de otro vaso donante (otra arteriola o vénula) y forma un asa capilar a través de la cual la sangre comienza a fluir. Si el flujo es suficientemente grande, los miocitos pequeños
invaden finalmente la pared, por lo que algunos de los vasos nuevos finalmente se convertirán en arteriolas o vénulas nuevas o incluso en vasos más grandes. Es decir, la angiogenia explica la forma en que los factores metabólicos de los tejidos
locales provocan el crecimiento de vasos nuevos. Algunas sustancias, como algunas hormonas esteroideas, tienen exactamente el efecto contrario sobre los vasos sanguíneos pequeños, en ocasiones causando incluso la disolución
de las células vasculares y la desaparición de los vasos. Por tanto, los vasos sanguíneos también pueden desaparecer cuando no se necesitan. Los péptidos producidos en los tejidos pueden bloquear también el crecimiento de nuevos vasos
sanguíneos. Por ejemplo, la angiostatina, un fragmento del plasminógeno proteico, es un inhibidor de la angiogenia de ocurrencia natural. La endostatina es otro péptido antiangiogénico que se deriva de la descomposición del colágeno tipo XVII. Aunque siguen sin conocerse las funciones fisiológicas precisas de estas sustancias antiangiogénicas, existe un gran interés en su uso potencial para detener el crecimiento de los vasos sanguíneos en tumores cancerosos y, por tanto, para prevenir los grandes aumentos en el flujo sanguíneo necesarios para sostener el suministro de nutrientes de tumores en rápido crecimiento.
La vascularización se encuentra determinada por la
necesidad de flujo sanguíneo máximo, no por la necesidad
media.
Una característica especial de gran valor del control vascular a largo plazo es que la vascularización se determina principalmente por el nivel máximo de flujo sanguíneo necesario y no por la necesidad media. Por ejemplo, durante el ejercicio intenso el flujo sanguíneo de todo el cuerpo aumenta el flujo sanguíneo en reposo hasta seis u ocho veces. Este mayor exceso de flujo puede no ser necesario más que durante algunos minutos cada día, aunque esta necesidad breve provoca la formación de VEGF suficiente en los músculos para aumentar su vascularización según necesidades.
Si no fuera por esta capacidad, cada vez que una persona intentara hacer un ejercicio intenso los músculos no podrían recibir los nutrientes adecuados, en especial el oxígeno necesario, por lo que los músculos no se contraerían. No obstante, después del desarrollo de esta vascularización extra los vasos sanguíneos extra se mantienen contraídos, abriéndose para permitir el flujo extra sólo cuando existan estímulos locales apropiados, como la falta de oxígeno, los estímulos nerviosos vasodilatadores u otros estímulos que provoquen el flujo extra necesario.
Desarrollo de la circulación colateral:
un fenómeno de regulación a largo plazo
del flujo sanguíneo local
Cuando se bloquea una arteria o una vena en cualquier tejido del organismo se desarrolla un canal vascular nuevo rodeando el bloqueo y permitiendo que se vuelva a suministrar sangre al tejido afectado, al menos parcialmente. La primera etapa de
este proceso es la dilatación de los bucles vasculares pequeños que ya conectan ese vaso proximal al bloqueo con el vaso distal. Esta dilatación se produce en el primer o segundo minutos, lo que indica que la dilatación está mediada probablemente
por factores metabólicos que relajan las fibras musculares de los vasos pequeños implicados. Después de esta apertura inicial de los vasos colaterales, el flujo es menor de la cuarta parte de lo necesario para cubrir todas las necesidades tisulares. No
obstante, la apertura se produce en las horas siguientes, por lo que antes de un día pueden estar ya cubiertas la mitad de las necesidades tisulares y en pocos días el flujo sanguíneo suele ser suficiente para cubrir todas estas necesidades.
Los vasos colaterales continúan creciendo durante muchos meses después, casi siempre formando muchos canales colaterales pequeños en lugar de un único vaso de gran tamaño. En reposo, el flujo sanguíneo vuelve muy cerca de los valores
normales, pero los nuevos canales son suficientemente grandes como para aportar el flujo sanguíneo necesario durante la actividad tisular agotadora. Es decir, el desarrollo de los vasos colaterales sigue los principios habituales del control a corto y largo plazo del flujo sanguíneo local, consistiendo el control a corto plazo en la dilatación metabólica rápida seguido crónicamente por el crecimiento e ingurgitación de los vasos
nuevos en un período de semanas y meses.

El ejemplo más importante de desarrollo de los vasos sanguíneos colaterales lo encontramos después de la trombosis de una de las arterias coronarias. Casi todas las personas tienen cerrada a los 60 años al menos una rama menor de los
vasos coronarios cerrados, o al menos parcialmente ocluidos. A pesar de ello, la mayoría de las personas no sabe que esto ha sucedido porque las colaterales se han desarrollado con la rapidez suficiente para prevenir el daño miocárdico. Es en los demás casos, en los que se desarrolla la insuficiencia coronaria con demasiada rapidez o con una intensidad excesiva para que se desarrollen las colaterales, cuando se desarrolla
el ataque cardíaco.
Control humoral de la circulación
El control humoral de la circulación se refiere al control por
las sustancias segregadas o absorbidas en los líquidos del
organismo, como hormonas y factores producidos localmente. Algunas de esas sustancias se forman en glándulas especiales y se transportan en la sangre por todo el organismo, mientras que otras se forman en algunas zonas del tejido afectado y provocan sólo efectos circulatorios locales.
Entre los factores humorales más importantes que afectan a la función circulatoria destacan los siguientes.
Sustancias vasoconstrictoras

Noradrenalina y adrenalina. La noradrenalina es una hormona vasoconstrictora especialmente potente; la adrenalina es menos potente y en algunos tejidos provoca incluso una vasodilatación leve. (Un ejemplo especial de vasodilatación
provocada por la adrenalina es la dilatación coronaria durante el aumento de la actividad cardíaca.) Cuando se estimula el sistema nervioso simpático en el
cuerpo durante el estrés o el ejercicio, las terminaciones nerviosas simpáticas de cada tejido liberan noradrenalina, que excita al corazón y contrae las venas y las arteriolas.
Además, los nervios simpáticos de la médula suprarrenal provocan la secreción de noradrenalina y adrenalina en la sangre. Estas hormonas circulan entonces por todo el cuerpo y provocan casi los mismos efectos en la circulación que la
estimulación simpática directa, con lo que se consigue un sistema de control doble:
- 1) estimulación nerviosa directa
- 2) efectos indirectos de la noradrenalina y/o de la adrenalina en la sangre circulante.
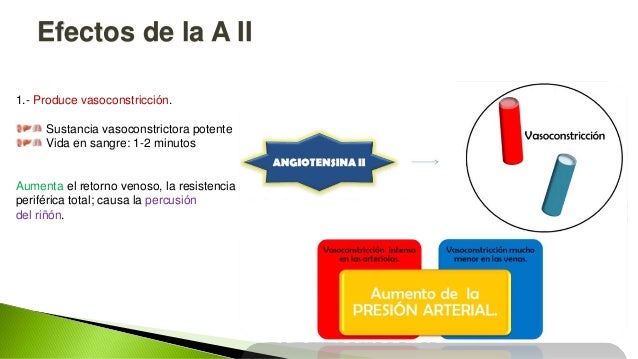
Angiotensina II. La angiotensina II es otra sustancia vasoconstrictora potente. Tan sólo una millonésima de gramo puede aumentar la presión arterial de un ser humano en
50 mmHg o más. El efecto de angiotensina II contrae potentemente las
pequeñas arteriolas. Si esto sucede en un tejido aislado, el flujo sanguíneo de esa zona disminuirá mucho, aunque la importancia real de la angiotensina II es que normalmente actúa sobre muchas de las arteriolas del organismo al mismo
tiempo, para aumentar la resistencia periférica total y aumentar la presión arterial. Es decir, esta hormona tiene un papel fundamental en la regulación de la presión arterial,
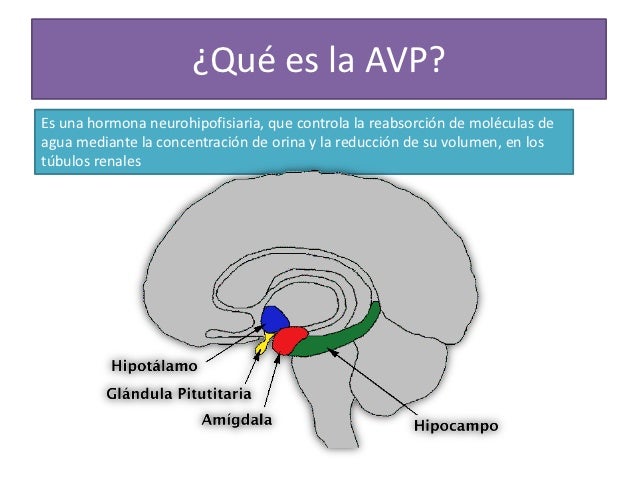
Vasopresina. La vasopresina, que también se conoce como hormona antidiurética, es aún más potente que la angiotensina II como vasoconstrictora, por lo que se convierte en una de las sustancias constrictoras más potentes del organismo. Se forma en las células nerviosas del hipotálamo, pero después se transporta distalmente a
través de los axones nerviosos hacia la neurohipófisis, donde
es finalmente segregada a la sangre.
Es evidente que la vasopresina podría tener efectos muy importantes sobre la función circulatoria. Sin embargo, sólo se segrega en cantidades mínimas en condiciones normales, por lo que la mayoría de los fisiólogos opina que su papel en el control
vascular es pequeño. No obstante, en estudios experimentales se ha demostrado que la concentración de vasopresina en sangre circulante puede aumentar después de una hemorragia intensa, lo suficiente como para elevar la presión arterial hasta
en 60 mmHg. En muchos casos, este mecanismo puede elevar por sí solo la presión arterial hasta la normalidad. La vasopresina tiene una función importante aumentando
la reabsorción de agua de los túbulos renales hacia la sangre, por tanto, ayudando
a controlar el volumen de líquido corporal. De ahí viene el nombre de hormona antidiurética.
Sustancias vasodilatadoras
Bradicinina. Hay un grupo de sustancias denominadas cininas que provocan una vasodilatación potente cuando se forman en la sangre y en los líquidos tisulares de algunos órganos.
Las cininas son pequeños polipéptidos que se escinden por enzimas proteolíticas a partir de 2-globulinas del plasma o los líquidos tisulares. Una enzima proteolítica de particular importancia para tal fin es la calicreína, que se encuentra
en la sangre y los líquidos tisulares en una forma inactiva. Esta calicreína inactiva se activa por la maceración de la sangre, por la inflamación tisular o por otros efectos químicos o físicos similares. A medida que se va activando la calicreína
actúa inmediatamente sobre la 2-globulina para liberar una cinina llamada calidina, que después se convierte en bradicinina gracias a las enzimas tisulares. Una vez formada, la bradicinina persiste durante sólo unos minutos, porque se
inactiva por la enzima carboxipeptidasa o por la enzima convertidora, la misma que participa en la activación de la angiotensina. La enzima calicreína activada se destruye por un inhibidor de la calicreína que también está presente en los líquidos corporales.
La bradicinina provoca una dilatación arteriolar potente y aumenta la permeabilidad capilar. Por ejemplo, la inyección de 1 mm de bradicinina en la arteria braquial de una persona aumenta el flujo sanguíneo a través del brazo hasta en seis veces, e incluso cantidades menores inyectadas localmente en los tejidos pueden provocar un edema local importante como consecuencia del aumento de tamaño de los poros capilares.
Hay razones para creer que las cininas tienen un papel especial en la regulación del flujo sanguíneo y en la pérdida capilar de los líquidos en los tejidos inflamados. También parece que la bradicinina participa normalmente en la regulación
del flujo sanguíneo en la piel y también en las glándulas salivares y gastrointestinales.

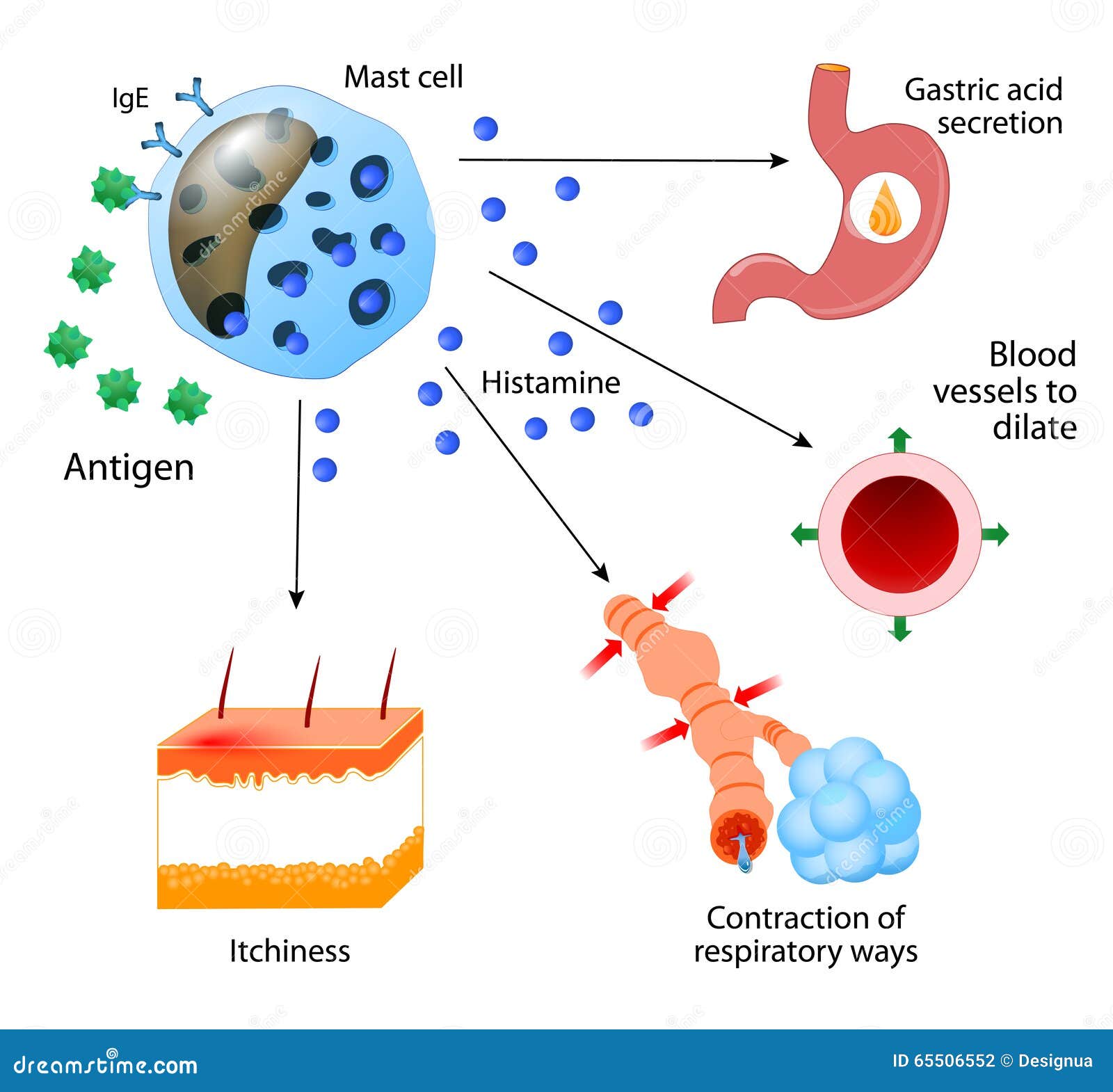
Histamina. La histamina se libera esencialmente en todos los tejidos del organismo cuando sufren daños o se inflaman, o cuando se sufre una reacción alérgica. La mayoría de la histamina deriva de los mastocitos en los tejidos dañados y de
los basófilos en sangre.
La histamina tiene un efecto vasodilatador potente sobre las arteriolas y, como la bradicinina, puede aumentar en gran medida la porosidad capilar permitiendo la pérdida tanto de líquidos como de proteínas plasmáticas hacia los tejidos. En
muchas situaciones patológicas la dilatación arteriolar intensa y el aumento de la porosidad capilar producida por la histamina provoca la pérdida de cantidades enormes de líquido desde la circulación hacia los tejidos, induciendo el edema.
Los efectos locales vasodilatadores y productores de edema de la histamina son especialmente prominentes durante las reacciones alérgicas
Control vascular por iones y otros
factores químicos
Hay muchos iones y otros factores químicos que pueden dilatar o contraer los vasos sanguíneos locales. La mayoría de ellos tiene una función escasa en la regulación global de la circulación, pero hay algunos efectos específicos, como son:
El aumento de la concentración del ion calcio provoca vasoconstricción, que es consecuencia del efecto general del calcio para estimular la contracción del músculo liso,
El aumento de la concentración del ion potasio, dentro del intervalo fisiológico, provoca vasodilatación, que es consecuencia de la capacidad de los iones potasio para inhibir la contracción del músculo liso.
El aumento de la concentración del ion magnesio provoca una vasodilatación potente, porque los iones magnesio inhiben la contracción del músculo liso.
El aumento de la concentración del ion hidrógeno (descenso del pH) provoca la dilatación de las arteriolas. Por el contrario, un descenso pequeño de la concentración del ion hidrógeno provoca la constricción arteriolar.
Los aniones que tienen efectos significativos sobre los vasos sanguíneos son los iones acetato y citrato, que provocan una vasodilatación pequeña.
El aumento de la concentración de dióxido de carbono provoca una vasodilatación moderada en la mayoría de los tejidos, pero una vasodilatación importante en el cerebro. Además, el dióxido de carbono en la sangre tiene un efecto indirecto muy potente al actuar en el centro vasomotor del cerebro, transmitido a través del sistema
nervioso simpático vasoconstrictor, provocando una vasoconstricción generalizada en todo el organismo.
La mayoría de los vasodilatadores o vasoconstrictores tienen un efecto escaso en el flujo sanguíneo a largo plazo salvo que alteren la tasa metabólica de los tejidos. En la
mayoría de los casos, el flujo sanguíneo en los tejidos y el gasto cardíaco (la suma del flujo en todos los tejidos del organismo) no se ven alterados sustancialmente, salvo durante uno o dos días, en estudios experimentales cuando se infunden
crónicamente grandes cantidades de potentes vasoconstrictores como la angiotensina II o vasodilatadores como la bradicinina. ¿Por qué el flujo sanguíneo no se altera significativamente en la mayoría de los tejidos aun en presencia de
cantidades muy elevadas de estos agentes vasoactivos? Para responder a esta pregunta debemos recordar uno de los principios fundamentales de la función circulatoria
que hemos comentado anteriormente: la capacidad de cada tejido de autorregular su propio flujo sanguíneo de acuerdo con las necesidades metabólicas y otras funciones del mismo.

La administración de un potente vasoconstrictor, como la angiotensina II, puede provocar descensos transitorios en el flujo sanguíneo tisular y en el gasto cardíaco, aunque por lo común tiene un efecto escaso a largo plazo si no modifica
la tasa metabólica de los tejidos. Análogamente, la mayo ría de los vasodilatadores provocan únicamente cambios a corto plazo en el flujo sanguíneo tisular y el gasto cardíaco si no alteran el metabolismo de los tejidos. Por tanto, el flujo sanguíneo
está regulado generalmente de acuerdo con las necesidades específicas de los tejidos siempre y cuando la presión arterial sea adecuada para perfundir los tejidos.
Cuestionario
•1.-¿Cual mecanismo resalta la estrecha conexión
existente entre la regulación del flujo sanguíneo local y el
aporte de oxígeno y de otros nutrientes a los tejidos?. -La hiperemia reactiva
2.-¿Cual proceso metabolico ocurre cuando cualquier tejido se vuelve muy activo.? – La hiperemia activa
3.-¿Que funcion tiene el NO (Óxido nítrico) el los vasos sanguineos? -Es un vasodilatador que permite la relajacion de los vasos sanguineos
4.-¿Cual es la sustancia vasoconstrictora más importante de las
células endoteliales? -Es la endotelina
5.- ¿Que sustancias son vasodilatadoras? -Bradicina y histamina